Lamm2000 本文
本文
術後アジュバントの膀胱内化学療法とBCGによる免疫療法はアジュバント治療をしない場合に比べて、初回再発までの期間を有意に延長する。Southwest Oncology Group (SWOG)による大規模なRCT(無作為臨床試験)は、BCG免疫療法がドキソルビシンやマイトマイシンによる化学療法に比べて、初回再発までの時間を有意に延長させることを示した。
治療後に付加的に決まった治療スケジュールを継続するという維持療法は、アジュバント膀胱内治療の効果をさらに進展させるものと推測されている。動物実験では、BCGによる再治療は、移植された移行上皮癌の増殖を効果的に減少させたが、それは先立つBCG治療の免疫刺激が減衰するのに十分な時間があった場合に限られた。初期の臨床試験では、4ヶ月に1回BCGの膀胱内注入を行って、100患者⁻月あたり1.9から0.49腫瘍数へと再発を4分の1に減少させた。他の研究では、4ヶ月あるいは毎月のBCG膀胱内注入療法と週1回6週間行う導入コースを比較したが、優劣の結果は出なかった。しかし、これらの研究は、規模が小さ過ぎて(統計的なパワーがない)、維持療法に利益がないという結論を得るには早計過ぎる。
初回再発の時間が延長されるということは、病気の悪化までの時間(たとえば進行)や生存時間を延長させることは、想定できることだが、私の知る限り実際には示されていない。この仮説は、より長い期間の結果に代わる潜在的な指標として、初回再発までの時間を指定している。しかしながら、大きくて成熟した表在性膀胱がんに対する膀胱内注入化学療法のRCTを統合した最近の分析では、再発に違いがあるにもかかわらず、長期効果を確定するには至らなかった。このように、今や、初回再発までの時間を結果とする代替状況に対抗する強いエビデンスがある。1985年に、SWOGの研究者は、標準導入治療に引き続き、アジュバントBCG維持療法をすることは、維持療法をしないことに比べて利益があるかどうかを調べるためのRCTを主導した。
方法
対象患者
患者は、研究に参加する前、6ヵ月以内に組織学的に膀胱の移行性上皮癌(transitional cell
carcinoma)だと確定されることが要件であった。乳頭腫瘍は完全に切除され、ステージTa(非侵襲性尿路上皮限局)または、T1(粘膜固有層浸潤)に分類された。患者は全て、再発の危険性が高いことが要件だった。再発は、1年以内に2つの腫瘍(初回と再発あるいは2回の再発)、最近6ヵ月以内に3つ以上(の腫瘍)、and/or 少なくとも1回のランダムバイオプシーでCIS(carcinoma in
situ)があることと定義された。除外された人は、ステージ2以上(筋層浸潤)の患者、膀胱癌で放射線療法を受けた患者、併用化学療法あるいは放射線療法の予定がある患者、膀胱癌ですでにBCG治療を受けた患者である。しかし、他の膀胱注入療法を受けた患者は参加することができた。適切な肝機能はビリルビンが2.0mg.%未満であることが要件だった。全ての患者は長期追跡されなければならなかった。FDAのガイドラインに則った研究計画書に示された書面による同意書にサインした。
治療
腫瘍切除から少なくとも1週間後に、患者はコンノート株(Connaught)BCG 81mg (120 mg. wet weight, 10.5±8.7×108 colony-forming
units)の導入療法を受けた。凍結乾燥BCGは、灌流のため、生理学的に静菌のない生理食塩水50.5ccに懸濁された。膀胱にカテーテルを挿入した後、50ccの懸濁液を点滴し、カテーテルを外した。患者は、15分間うつ伏せで居るように指示され、できれば2時間は懸濁液を保持するように指示される。同時に経皮的なBCG接種のため、内股をアルコールで拭いて、BCG懸濁液0.5cc(およそ107
colony-forming
units)を滅菌した28ゲージ針で皮膚を3回刺す。大腿は引き続く治療で交互に使う(注:日本で使用されるイムノブラダーは膀胱注入のみ、いかなる皮下注射も禁忌と薬剤添付文書に記載されているので同じ方法ではありません。by奈美)。膀胱注入療法と皮下注射の治療は1週間に1回、6週間繰り返した。尿道前立腺部の移行上皮癌の患者では、カテーテルを抜くときに5ccのBCG懸濁液を尿道前立腺部に注入し、2時間、カニンガム・クランプを適用した。
無作為化
導入コースを終えて、ツベルクリン反応を行った患者は、その結果(5mm以下あるいはより大きい硬結)と最初のCISの状態(研究参加の時点での有無)で層別化され、BCG維持療法群か維持療法なし群に無作為に振り分けられた。維持療法なし群の患者は、残っている、あるいは再発した病気の場合を除いて、治療は受けないことになっていた。維持療法群の患者は、1週間に1回の膀胱注入療法と皮下注射治療を3週間、最初の導入治療から3ヵ月目と6ヵ月目、その後、6ヵ月おきに3年間続けることになった。層別化に基づくダイナミックバランス(動的つり合い)を使った無作為化はSWOG統計センターにある中央コンピューターを使用した。
追跡
患者は治療に対する副反応を追跡するため、治療の前、膀胱鏡検査の時、また適応に応じて、短い病歴聴取と生理学検査を受けた。ツベルクリン反応、全血算、血清クレアチニン、肝機能検査は膀胱鏡検査のたびに行った。現存疾患(主にはCIS)のある患者は、治療に対する反応を査定するため、膀胱鏡検査、尿細胞診、膀胱バイオプシーを行った。腫瘍のないケースでは、膀胱鏡と尿細胞診を3ヵ月ごとに2年間、その後、6ヵ月ごとに2年間、その後は1年ごとに行った。CISの患者は、膀胱バイオプシーを3ヵ月目と6ヵ月目に、その後は、疑いがある場合のみ、尿細胞診あるいは膀胱鏡検査を行った。目に見える再発のある患者は、病理学検査によって確定するため、腫瘍切除を行った。
有効性エンドポイント
CISのCR(Complete
response)は、膀胱バイオプシーで組織学的な悪性の消失と尿細胞診の異常がなくなることである。CISのない患者と、最初の層別化でBCG導入治療後にCRに分類されたCISの患者の治療効果は、再発のない期間である。疾患の進行も査定された。治療的な介入は、バイオプシーでステージの進行が確定される前に始められることが多いので、疾患の悪化を見るための結果が必要であり、バイオプシーの結果がステージT2以上、あるいは進行や悪化による治療方針の変更開始を疾患の悪化の結果と定義した。進行や悪化による治療方針の変更には、膀胱切除、全身化学療法、放射線療法、あるいは、表在性疾患の治療戦略の中止を示す他の療法が含まれた。全ての患者は死亡まで追跡された。
研究デザインの考慮事項
研究デザインは、導入療法のおよそ3ヵ月間を含み、患者が無作為に割り当てられた後は前述したとおりである。私たちのゴールは、表在性膀胱癌の患者で、導入療法後の疾患徴候がない患者に維持療法が有益かどうかを査定することだ。私たちは、維持療法の主要な効果査定に焦点化したので、無作為化の段階で疾患の徴候があった患者は、一次分析に含めていない。無作為化の段階で疾患の徴候がないことは、無作為化手順において独立しているので、無作為化において疾患徴候のない患者に焦点化していることは、私たちの結果にバイアスを与えるものではない。
統計学的方法
治療群の比較のための主要なエンドポイントは、無再発期間である。先立つSWOG研究で、およそ2年間の無再発期間の中央値が観察されていたので、これを、維持療法なし群の治験サイズを計算するために使用した。type 1
error(第1種の過誤)の確率を0.05(片側)とし、検出力を0.8に設定した場合、無再発期間における50%以上の改善を検出するためには、およそ400人の患者が必要と推測された。参加患者が100人になったところで、3つの中間解析が計画された。公式の中間解析の有意水準は、0.003、0.004、0.005であり、type 1
errorの確率を0.05に保持すると、最終分析の有意水準は0.048になった。研究は、このゴール数に到達するまで続けられた。
一次分析は治療群によるもので、無作為化の段階で疾患の徴候がない患者について、層別化した片側のログランク検定を用いた。層別化は、導入治療登録の時点でのCISの有無、無作為化の時点でのツベルクリン反応(陽性/陰性)だった。BCG維持療法が結果を改善しているかどうかを確認するためのデザインなので、片側検定を行った。無作為化の時点から、再発、疾患の悪化、死亡までの時間が測定された。共変量の存在における脱落事象発生時間(failure
time)の結果に関する探索的解析は、コックス比例ハザード回帰分析を使って行った。先立つ治験の結果から、維持療法群での無再発期間の有意な改善が強く示唆されていた。本研究では、オリジナルプロトコルでは定義されていない長期効果の分析を含め、先行研究の結果を拡張し刷新した。治験は10年以上前に終了した。長期的な結果は、維持療法の適用に固有のトレードオフ、いわゆるより大きな有害性や患者にとって重要な不都合について、臨床医が査定するのに役立つ。
結果
患者の特徴
SWOGの81施設から660人が1985年12月から1988年12月にBCG免疫療法の導入治療に登録し、550人が引き続き無作為化に参加した。維持療法なし群の5人と維持療法群の7人の患者が、無作為化前の同意確認の時点で参加しないことを表明し、それぞれ78人と76人の患者は無作為化の時点で疾患の徴候があったため、一次分析には含まれなかった。したがって、結果は、それぞれの群で疾患の徴候がなかった192人を比較したものである。284人の人口統計学的データと記述統計を表1に示す。人種、年齢、CISやツベルクリン反応の有無による無作為化の有意な偏りを見られなかった。

脱落事象発生時間分析Failure time analyses
図1は、無作為化した群それぞれの無再発期間、非悪化期間、生存期間について、カプランマイヤープロットを描いたものである。無再発期間の層別化ログランク統計量はp<0.0001で、維持療法が有意に再発を遅らせる利益があることを示した。250件の再発あるいは死亡事例のうち、49件は再発がない死亡だった。それぞれの群の無再発期間、非悪化期間の分析の詳細は表2に示す。

非悪化期間の層別化ログランク統計量はp=0.04(表2)だった。有意水準の定義はプロトコルにはないが、p値が小さいということは、維持療法が疾患の悪化に関しても利益があるということを示唆している。さらなる追跡によって数が増えれば、より強い結論を導くことができるだろう。生存期間については、p値が0.08であり、弱い示唆にとどまるが、さらに数が増えれば、有意な違いを導くことができるだろう。5年生存率は維持療法なし群で78%、維持療法群で83%だった。
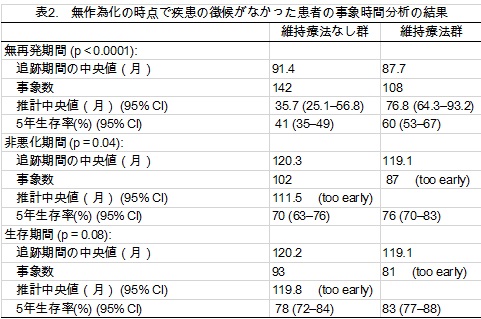
これら3つの事象時間結果の詳細な探索的分析は、比例ハザード回帰モデルを用いて行った。結果と無作為化群と間には、前述した関係以外に特記すべき共変関係はなかった。とくに、CISやツベルクリン反応の状態は、いずれのモデルにおいても有意ではなく、これらの層別化した因子は予後を予測するものではなかった。
有害性
導入治療の有害性を評価した599人の患者のうち、全身感染のためにBCG関連死が2件あったという先行報告があった。維持療法群では、グレード3を超える有害事象は記録されなかった。243人の維持療法群のうち、3年間に全8回の予定された維持療法コースを完遂したのは、たった16%だった。
CISの治療応答
本治験は、維持療法に対するCISの応答を評価するために特化されたデザインではないが、両群のCR(complete
response)率を評価することはできた。CISのある278人の患者が導入治療に登録し、治療後3ヵ月目の評価で疾患の徴候がない(CR)は、141人(50.7%)だった。278人のうち、116人が維持療法なし群、117人が維持療法群に割り当てられた。3ヵ月目の時点で、疾患の徴候がなかったのは、66人(56.9%:66/116)が維持療法なし群、64人(54.7%:64/117)が維持療法群だった。予測どおり(無作為割り当てだから?)、両群の応答率に有意差はなかった(p=0.8)。最終的には、維持療法なし群でCISのあった13人の患者がCRになったので、全体のCR率は68.1%(79人:66+13)になった。追加治療の結果、維持療法群の34人がCRになったので、全体のCR率は83.8%(97人(1人少ない?:64+34-1?))になった。両群の全体CISの応答率は有意差があった(p=0.004)。このように、非応答性のCISにおいても、付加的なBCG注入の利益の強いエビデンスが得られた。前述した無再発期間の分析は、6週間後に応答が得られたCISの患者についても、付加的なBCG注入は利益があることを示した。
他のSWOG研究との比較
図2はCISのない患者での無再発期間カプランマイヤーの比較を示している。OBS8507(維持療法なし群)とBCG8507(維持療法群)、SWOG先行研究におけるBCG治療対ドキソルビシン治療を比較したBCG8216、SWOG先行研究のBCG治療群の継続研究で、BCG治療対マイトマイシンC治療を比較したBCG8795である。

BCG8216の治療では、コンノート株BCGを膀胱注入と皮下注射を1週間に1回、6週間、その後3ヵ月ごとに1回維持療法を2年間続けた。BCG8795のBCG治療群は、タイス株BCGの膀胱注入を1週間に1回、6週間、その後2週間あけて、8週目から11か月間、毎月1回行った。OBS8507とBCG8507の比較は例外で、SWOG参加施設がほぼ同じ参加基準を使って、患者を登録したという以外に、両群(BCGによる維持療法なし群とあり群)の患者に差がないという想定はない。しかし、彼らが独立した資源から来ていたとしたら、もっと類似しているだろう、というのは、参加基準と患者資源は、これらの治験で極めて類似しているからだ。BCG8507の維持療法群は、他の治験群より明らかに上で、他の3群には一般的な類似点がある(図2)。この比較は、毎月あるいは3ヵ月に1回のBCG膀胱注入を続けても、標準導入治療の6週間治療と比べて、効果に大差はないということを示唆している。
考察
Moralesらが、組織学的研究で、術後のBCG膀胱注入が腫瘍の再発を減少させると報告してから、無作為研究によって、BCGは手術のみよりも優れていることが示された。SWOGの先行研究でも、BCG免疫療法は、膀胱注入化学療法よりも優れていることが示されている。BCGはCISと、再発の速いあるいはハイリスクステージのTa、T1移行上皮癌の治療選択として一般的に受け入れられている。
膀胱注入化学療法あるいはBCG療法の維持療法スケジュールに関する、無作為化による先行研究では、維持療法スケジュールの有意な利点を示すことができなかったが、その多くは否定的な結論を出すには小さすぎるサンプルだった。私たちのBCG免疫療法を3週間行う維持療法の観察では、BCGの効果に関する証拠として、無疾患期間が2倍(77対36ヶ月)になっている。無疾患期間の分布における、この大きな有意差(ログランクp<0.0001)は、通常行われる6週間の導入治療のみに対して、3週間スケジュールの維持療法がすぐれていることを示している。
私たちの延長した追跡調査によって、BCG免疫療法の維持の長期効果を評価する貴重な機会が得られた。再発に関する大きな有意差に加え、維持療法は疾患が悪化するあるいは死亡までの時間も有意に延長しており(p=0.04)、生存期間延長への利益も示唆された(p=0.08)。手術のみに対する、BCGの導入療法あるいは、短期間のBCG療法を無作為に比較した2つの研究でも、疾患の進行を有意に減少させたことが報告された。この結果は驚くべきものだ。というのは、表在性膀胱癌患者における進行のハザード率は低いため、疾患の進行に対する効果を示すことが難しいからだ。
私たちが示したBCG3週間維持療法の長期効果は、治療分析を意図したものだ。私たちの一時的エンドポイントである無再発期間に関する有意な結果は、先行的に報告されていた。この延長した結果を含む治験の完全な公表は見送られていた。その理由は、初期の報告が、無疾患期間に基づく、患者の利益を要求する臨床的な重要性に関して、議論を巻き起こしたからだ。無悪化期間の長期的な結果は、分析計画のプロトコルにはなかったが、おおもとの無作為化デザインにはのせてあった。しかしながら、このような状況下では、第一種の過誤(type
I error)のリスクが高まり、ないはずの有意性が出てしまう。状況の複雑性から生じる第一種の過誤は、コンピューターによる補正では修正されない。そういうわけで、読者は無悪化期間に関する統計的な結果の解釈には、ある程度の注意を払う必要がある。
3週間維持療法スケジュールの長期的な利益が示されたことは、膀胱癌治療に関する重要な影響がある。この治験の結果が出る前は、治療方針は、経済的なコストや利便性、患者の好みに焦点を当てていた。進行しない期間の延長を含む、長期的な効果が示されたことで、推奨治療は劇的に変化すべきである。現行では、多くの泌尿器科医が、6週間の導入治療の後、再発時に2回目の6週間治療を行っている。6週間の導入治療と、導入治療後、半年ごとに、6週間週1回の注入療法を2年間続けた場合を比較しても利益を示すことは出来なかった。私たちの研究の維持療法なし群に含まれる多くの患者は、再発時に2回目のBCG6週間コースを受けたと思われるが、BCG免疫療法の6週間コースの繰り返しは、最適な方法とはいえない。
私たちの3週間維持療法スケジュールで観察された独特の成功には、メカニズムに関する可能な説明がいくつもある。一つのアンチゲンへの曝露に引き続く2次的な免疫反応は、より迅速で強く起こる。BCG膀胱注入療法の最初のコースを受けた患者の、尿中サイトカイン排泄によって測定された免疫刺激は、一般的に6週間の時点でピークになる。しかし、引き続き膀胱注入を行うと、免疫刺激は一般的に3週間でピークになり、4、5、6週に毎週膀胱注入を行うと抑制される。免疫刺激の期間とBCG膀胱注入後の再発の予防は長期にわたるが、リンパ球浸潤、遅延性の皮膚過敏反応、HLA-DRと免疫増殖応答が継続するのは6ヵ月程度だ。そういうわけで、6ヵ月目の維持療法スケジュールは、生物学的に重要かもしれない。維持療法3年という期間は、利便性のために選択した。私たちの知る限りでは、3週間の維持療法に引き続き3ヵ月に1回の注入療法、毎月の注入療法、あるいは再発の時点で6週間コースを超える治療を無作為で比較した研究はない。BCG治療の手法を改善するための今後の研究では、利便性、安全性、経済的コストに加え、免疫応答の生物学も考慮すべきである。
療法の治療群ともにMoralesらの原著で述べられたBCGの皮下注射が含まれており、コンノートBCGとドキソルビシンのSWOG比較研究でも使用した。BCGを膀胱注入のみで行った場合の、引き続く好ましい結果と、小さいサイズ(十分な検出力が得られない)対照研究では有意な利益を示すことが出来なかったことから、ほとんどの泌尿器科医は今や皮下注射の処方は行っていない。私たちの研究は、維持療法で毎週1回、3週間まで行う注入療法の優位性を明らかに示している。しかし、BCGの皮下注射の使用を非難するデータは、BCG維持療法を非難する先行データと同じくらい弱い。BCGの皮下注射が有益か無益かを決定づける大規模無作為化試験が必要であろう。
私たちの3週間、3年のBCG維持療法スケジュールは、CISとハイリスクのTaとT1移行上皮癌の治療選択として推奨されうるものだが、不当な副作用を避ける注意は払わねばならない。私たちの患者では、1回目か2回目の注入維持療法で、深刻なあるいは長引く排尿障害、発熱や不調のような副作用があった場合は、2回目か3回目を差し控えた。増加する副作用に対する治療の差し控えによって、この治験での維持療法期間の深刻な有害事象は避けられたが、同時に維持療法をスケジュール通りに完遂した患者の数が少なくなった(16%)。減量したBCGの安全性と効果を評価する研究は、計画中あるいは準備段階だが、それが完了するまでは、私たちは副作用が増加している患者では、2回目か3回目の注入療法で、差し控えることを推奨する。